【玉川大学脳科学研究所 研究成果】ニホンザルの視覚野から多数の神経細胞のイメージングに成功!ー微小内視鏡カルシウムイメージング法を用いた先進的な成果ー科学雑誌"Scientific Reports"に論文を発表
玉川大学脳科学研究所(東京都町田市 所長:坂上雅道)の小口峰樹(おぐちみねき)特任准教授、坂上雅道(さかがみまさみち)教授らは、先進的な神経細胞計測技術である微小内視鏡カルシウムイメージング法を用いて、マカクザル(ニホンザル)の第1次視覚野(V1)からの神経活動記録に初めて成功しました。いままで霊長類からの神経活動記録では電極を使った電気生理的な手法が主に用いられてきましたが、本研究成果は、霊長類を用いた神経活動記録の新たな実験手法の可能性を示唆するものであり、今後の更なる活用が期待されます。本研究成果は、8月23日(月)に科学雑誌“Scientific Reports”に掲載されました。
- 掲載論文名
Microendoscopic calcium imaging of the primary visual cortex of behaving macaques
課題遂行中のマカクザル第一次視覚野からの微小内視鏡カルシウムイメージング
https://www.nature.com/articles/s41598-021-96532-z
この研究のポイント
- これまで主にげっ歯類での研究に用いられてきた微小内視鏡カルシウムイメージング法をマカクザルの視覚野に初めて適用し、多数の神経細胞の活動を観察することに成功した。
- 観察された細胞群のデータから、視覚野の細胞に特徴的な性質(受容野特性や傾き選択性)を再現し、サルが見ている刺激のデコーディングや日を跨いだ同一細胞の追跡に成功した。
- 微小内視鏡法は脳深部からの神経活動記録や自由行動下の動物からの記録などに適しており、本研究の成果は霊長類を用いた新たな実験パラダイムの可能性を切り拓くものである。
研究の背景
これまで、マカクザルを含む霊長類からの神経活動記録においては、電極を使った電気生理学的な手法が主に用いられてきました。これは、神経細胞が活動する時の電気的な信号変化を捉えるものです。一方で、神経細胞が活動する時には、細胞内部でのカルシウムイオンの急激な濃度の上昇も生じます。このカルシウムイオン濃度の変化を蛍光信号に変換し、多数の神経細胞の活動を同時に可視化する技術が「カルシウムイメージング」です。カルシウムイメージングでは、カルシウムイオンに結合し、蛍光を発する特殊なセンサー(カルシウム感受性色素やカルシウムインジケーター)を用いて、このイオン濃度の上昇を蛍光顕微鏡によって直接光学的に観察します。
カルシウムイメージングには、主なものとして、大掛かりな2光子顕微鏡を使って脳表面から記録するやり方(2光子顕微鏡法)と、脳内に微小な筒形の屈折率分布型(GRIN)レンズを埋め込み、コンパクトなミニチュア顕微鏡を使って観察するやり方(微小内視鏡法)があります。微小内視鏡法は、時間・空間解像度では2光子顕微鏡法に劣りますが、脳深部からの神経活動記録や自由行動下における記録に適しているというメリットがあります。微小内視鏡法はこれまで主にマウスなどのげっ歯類の研究に用いられてきましたが、技術的なハードルから、霊長類への適用例はほとんどありませんでした。
そこで我々は、マカクザルの第1次視覚野(V1)をターゲットとして、微小内視鏡法を適用するためのメソッドを開発しました。V1の神経細胞は視覚刺激によって容易に活動を誘発することができ、また、視野内の特定の場所に反応したり(受容野特性)、特定の傾きの刺激に反応したり(傾き選択性)といった特徴を持つことが知られています。
実験方法
今回の実験では、まず、カルシウムインジケーター(GCaMP6s)を神経細胞に合成させるため、京都大学霊長類研究所(高田昌彦研究室)で新たに開発された、霊長類での感染効率の高いアデノ随伴性ウイルスベクター2.1型(AAV2.1)を用い、微細なガラスマイクロピペットを使ってV1へのベクター注入を行いました。皮質組織への刺入を容易にするため、先端に三角柱型プリズムの付いたプリズムプローブを用い、一部のサルでは小型蛍光顕微鏡を使って発現箇所を確認しながら、GRINレンズの留置と固定を行いました(図1)。その後、ミニチュア顕微鏡を取り付けるためのベースプレートを、焦点が合うように位置を調整しながらレンズ周辺に固定しました。
記録実験の行動課題としては、簡単な注視課題を用いました。サルがモニター中央に呈示される注視点を見つめていると、一瞬、視野周辺に特定の傾きをもった視覚刺激(ガボールパッチ)が呈示されます(図2)。サルは刺激呈示中も注視点を見続ける必要があり、一定時間注視を続けると報酬が得られます。微小内視鏡法では、ベースプレートにミニチュア顕微鏡を取り付けるだけでイメージングを行うことができます。視野内のさまざまな位置にさまざまな傾きをもった刺激を繰り返し呈示し、留置したGRINレンズからの蛍光信号を記録しました。
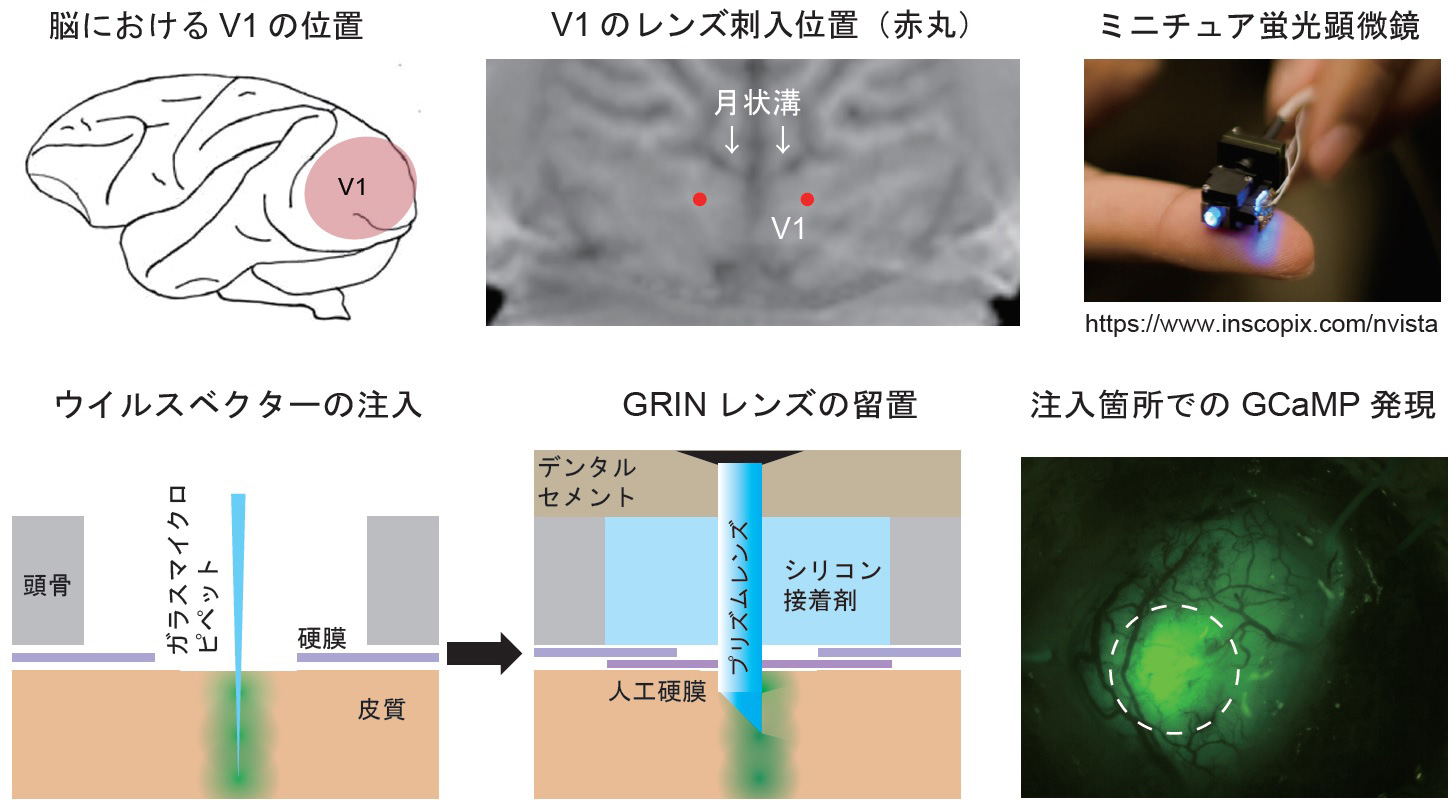
図1 標的部位と微小内視鏡法における手術の工程
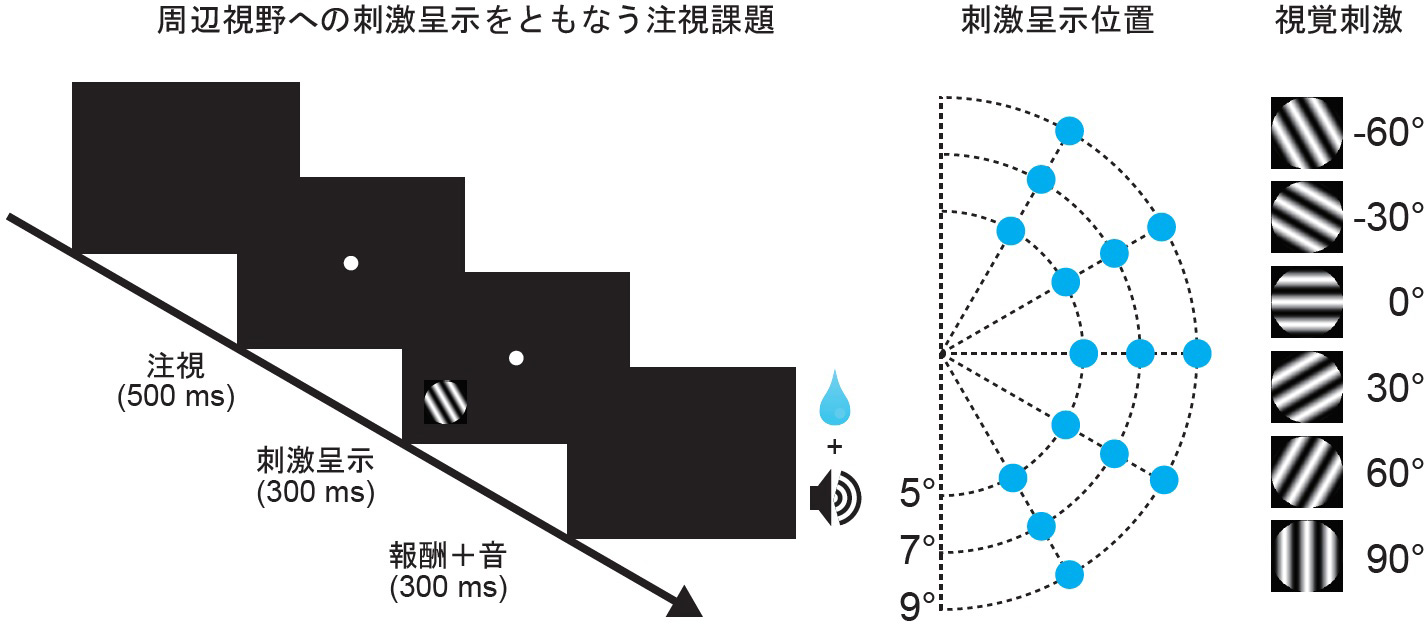
図2 行動課題と呈示刺激
実験結果
3頭のサルに対してウイルスベクター注入とGRINレンズの留置を行ったところ、2頭のサルの3つの大脳半球から、視覚刺激に対して応答を示す多数の神経細胞を観察することができました。
これらの映像から神経細胞を検出し、その蛍光変化のデータを用いて解析を行ったところ、観察された神経細胞は特定の位置に呈示された刺激に対して特異的に反応する(受容野をもつ)ことが分かりました。また、多くの神経細胞は特定の傾きに対して強く応答する(傾き選択性をもつ)ことも確認できました(図3)。
また、得られた多数の細胞からの蛍光信号のデータを用いて、サルが見ている視覚刺激の傾きを機械学習の方法を使って解読する(デコーディングする)ことにも成功しました(図4)。
微小内視鏡法では、カルシウムインジケーターを発現した神経細胞群とGRINレンズの観察面との位置関係が安定している場合、日を跨いで同じ細胞を観察し続けることができます。我々は異なる日に得られたデータを使って細胞追跡を行い、多数の細胞を同定することにも成功しました(図5)。
以上の結果は、微小内視鏡カルシウムイメージング法がマカクザルなどの霊長類においても有効な観察法として利用可能であることを実証するものです。また、V1細胞が持つさまざまな特性を再現し、デコーディングや細胞追跡などの解析に成功したことは、微小内視鏡法が、視覚野以外の脳領域(たとえば高度な認知機能に関わる前頭前野)などにおいても、局所的な神経回路のダイナミクスを多面的に解析するために有用であることを示しています。
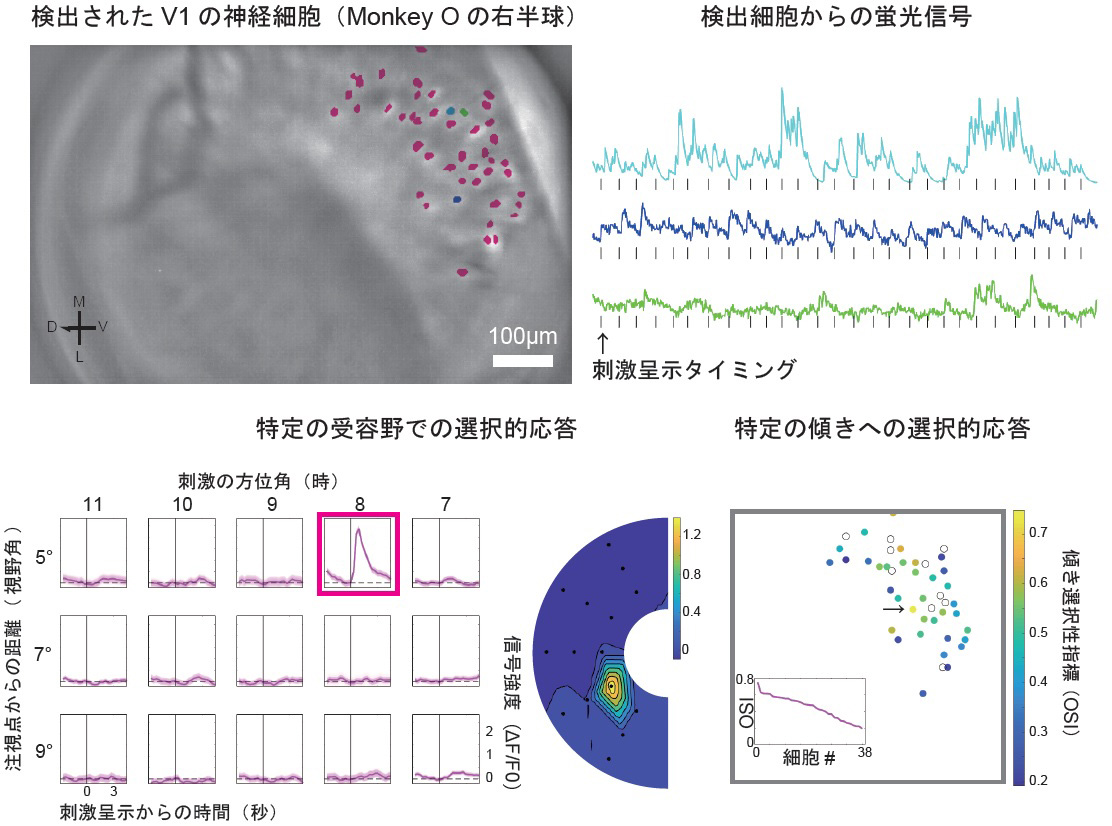
図3 検出された細胞群と受容野特性および傾き選択性
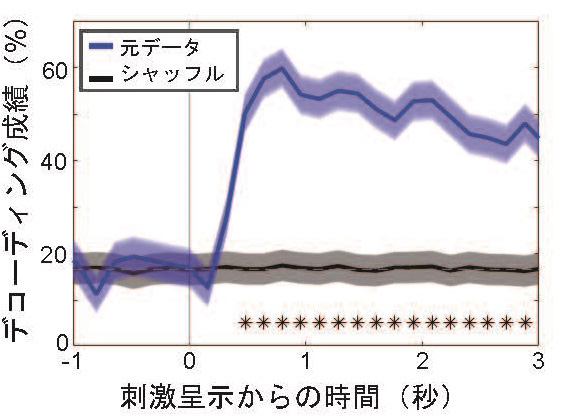
図4 視覚刺激の傾きのデコーディング
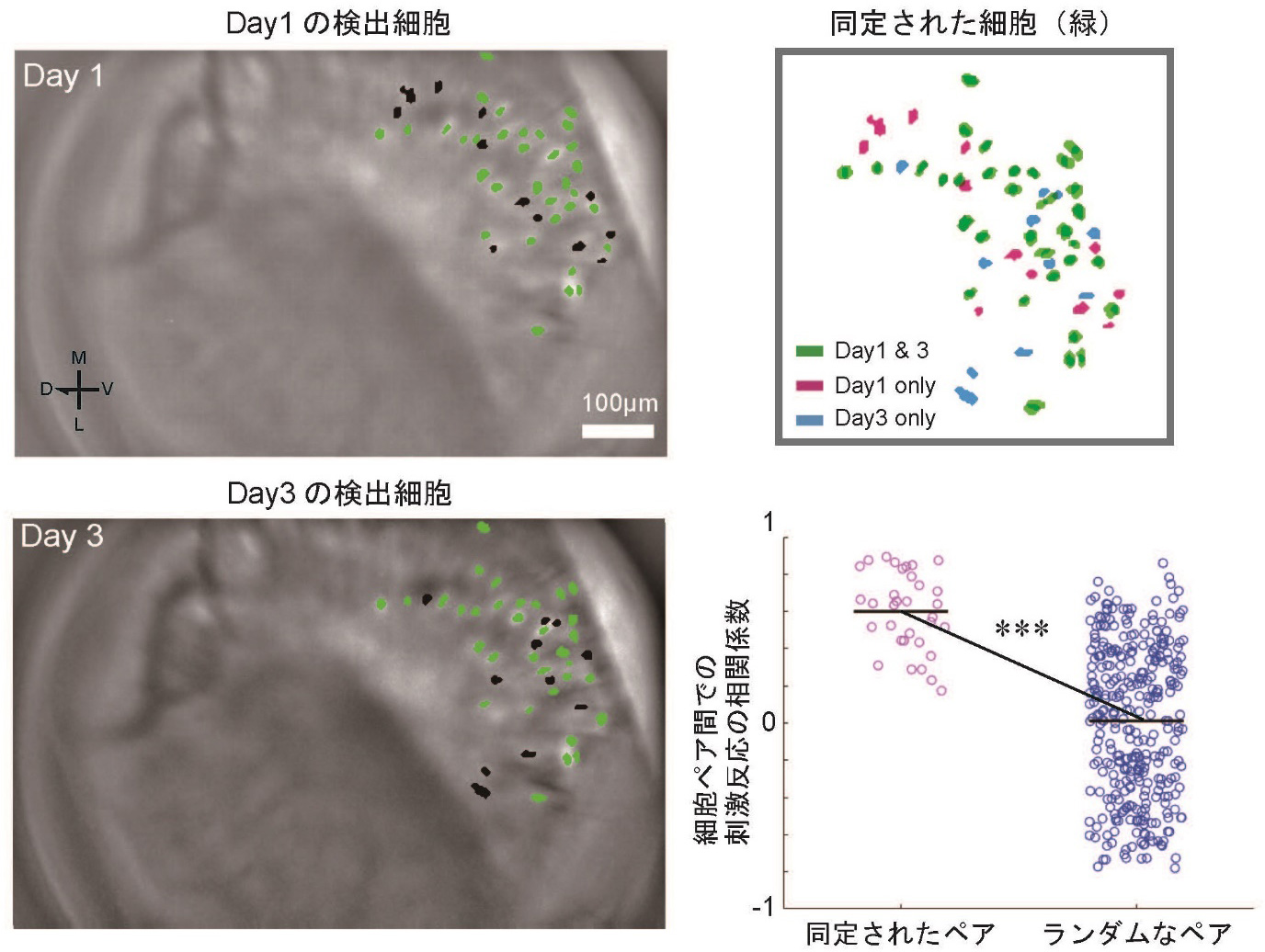
図5 日を跨いだ細胞の追跡
研究グループ
- 玉川大学脳科学研究所
特任准教授 小口 峰樹(おぐち みねき)
- 玉川大学大学院脳科学研究科
博士課程 蔣 嘉森(しょう かしん)
- 玉川大学脳科学研究所
研究員 吉岡 敏秀(よしおか としひで)
- 玉川大学脳科学研究所
准教授 田中 康裕(たなか やすひろ)
- 京都大学霊長類研究所
助教 井上 謙一(いのうえ けんいち)
- 京都大学霊長類研究所
教授 高田 昌彦(たかだ まさひこ)
- 麻布大学獣医学部
教授 菊水 健史(きくすい たけふみ)
- 獨協医科大学医学部
講師 野元 謙作(のもと けんさく)
- 玉川大学脳科学研究所
教授 坂上 雅道(さかがみ まさみち)