【玉川大学脳科学研究所 研究成果】「我慢」を担う脳内機能を因果的なレベルで特定に成功! 前頭前野-線条体経路が抑制コントロール機能を担うことを解明 ─マカクザル大脳での化学遺伝学2重遺伝子導入法を用いた実証的成果─
玉川大学脳科学研究所(東京都町田市 所長:坂上雅道)の小口峰樹(おぐちみねき)特任准教授、坂上雅道(さかがみまさみち)教授らは、特定の薬剤を用いて神経細胞の活動を制御する化学遺伝学を用い、前頭前野の外側部から線条体の尾状核へ向かう神経経路を選択的に操作することで、この経路が「抑制コントロール機能(我慢)」を担っていることを因果的なレベルで解明しました。この研究により、当該経路との関係が指摘されているさまざまな精神疾患(統合失調症や注意欠陥多動性障害、強迫性障害、薬物依存症など)の病態解明や、DREADD(人工受容体の一種)を用いた神経回路の薬理的操作による新たな治療法の開発へも結びつくことにも期待されます。本研究成果は、9月16日(木)に科学雑誌“Communications biology” に掲載されました。
掲載論文名
Chemogenetic inactivation reveals the inhibitory control function of the prefronto-striatal pathway in the macaque brain
化学遺伝学的不活化によるマカク前頭前野-線条体経路の抑制コントロール機能の解明
この研究のポイント
- これまでの手法では難しかった特定の神経経路の可逆的操作を、化学遺伝学2重遺伝子導入法を用いてマカクザルの前頭前野-線条体経路で実現した。
- この手法による経路選択的操作を行うことで、課題遂行中のサルにおいて忍耐力の低下と衝動性の亢進が生じ、これと関連する脳の信号が減弱化することを見出した。
- これにより、前頭前野から線条体へ向かう神経経路が抑制コントロール機能(我慢)を担うことを因果的なレベルにおいて実証した。
研究の背景
私たちの脳が果たすさまざまな機能は、膨大な数の神経細胞によって織りなされる複雑な神経ネットワークを通じて実現されています。こうした脳機能を検証するためには、特定の神経細胞の活動を人為的に抑制し、その結果として行動や他の神経細胞の活動にどのような変化が生じるかを調べるという方法があります。これまで、こうした因果的な介入においては、特定の部位の神経細胞を局所的に冷却したり、作動薬や拮抗薬を直接投与して操作したりといった手法がとられてきました。しかし、こうした介入はその部位を通るさまざまな神経回路に対して無差別に作用してしまいます。神経回路と脳機能との関係を解きほぐすためには、特定の神経経路に対してのみ影響を及ぼす選択的な手法が必要となります。近年、遺伝子工学的な技術の進展により、こうした経路選択的な介入手法がげっ歯類での研究を中心に盛んになってきています。しかし、よりヒトとの近縁性の高い霊長類ではまだ十分に適用が進んでいません。
私たちの研究グループは、こうした手法をマカクザル(ニホンザル)の脳に導入しました。ここでは、無毒化したウイルス(ウイルスベクター)を用いて神経細胞に人工受容体を発現させ、特殊な薬剤を投与することでその細胞の活動を制御することを可能とする「化学遺伝学」を利用しました。この化学遺伝学を、標的とする経路の出発点と終着点に別々のウイルスベクターを注入することで、両方のベクターに感染した細胞にのみ遺伝子導入を行う「2重遺伝子導入法」と組み合わせ、脳内の特定の神経経路を担う細胞のみを操作することを試みました。
私たちが標的としたのは、前頭前皮質の外側部(lateral prefrontal cortex: LPFC)から皮質下の線条体尾状核(caudate nucleus: CdN)へ投射する経路です。このLPFC-CdN経路は、意思決定において重要な役割を果たすと考えられており、ヒトのイメージング研究などによって「抑制コントロール機能」や「ワーキングメモリー機能」との関連が示唆されてきました。しかし、この経路を対象とした、経路選択的な操作を用いた因果的なレベルでの解明はいまだ手つかずの状態でした。
実験方法
この研究では、LPFC-CdN経路を選択的に不活化するために、DREADD(ドレッド、“Designer Receptor Exclusively Activated by Designer Drugs” の略)と呼ばれる人工受容体の一種を用いました。私たちが用いた変異型ヒトムスカリン受容体(hM4Di)は、体内には通常存在しない薬剤(clozapine-N-oxide: CNOなど)を作動薬として受け取ることで、それが発現した細胞の活動を抑制するDREADDです。
このDREADDをLPFC-CdN経路を構成するニューロンにのみ選択的に発現させるために、2種類のウイルスベクターを用いる2重遺伝子導入法を適用しました(図1a)。経路の終着点となるCdNには、組み換え酵素のCreを組み込んだウイルスベクター(NeuRet)を注入します。このウイルスベクターは、CdNに投射している神経細胞の軸索終末から逆行性に感染し、細胞体に到達して遺伝子導入を行います。出発点となるLPFCには、DREADDを組み込んだ、注入部位でローカルに感染するウイルスベクター(AAV5)を注入します。このベクターにはCreが作用することで初めてDREADDの発現が可能となるような仕組み(Cre/loxP)が用いられています。CdNに軸索を伸ばすLPFCニューロンのみがこれらのベクターに2重に感染し、細胞内ではCreが産生されることでDREADDが発現するようになります。そして、静脈内注射で投与した作動薬を作用させることで、DREADDが発現した細胞の活動を人為的に制御することができます。
私たちは2頭のサルにこの化学遺伝学2重遺伝子導入法を用いました。これらのサルには、あらかじめ、抑制コントロールとワーキングメモリーへの影響を同時に検証可能な課題として、報酬が非対称的に配分されるサッケード遅延反応課題(One-Direction Reward saccade task: 1DR課題)を訓練しました(図1b)。この課題では、サルがディスプレイ上の注視点を見つめている間、左右いずれかに一瞬だけ手がかり刺激が呈示されます。その後、遅延時間が挟まれ、サルはこの手がかり刺激の位置を記憶しておかなければなりません(ワーキングメモリー)。注視点が消えるのを合図として、サルは手がかり刺激の呈示された位置に視線を移動し、正解であれば報酬がもらえます。報酬量は左右で異なっており、あるブロックでは左が大報酬、右が小報酬となります。報酬量の左右の配分はブロックごとにランダムに切り替わります。不正解の場合には、サルは同じ試行をもう一度繰り返さなければなりません。したがって、将来的に大報酬を得るためには、やる気の出ない小報酬試行でもサルは我慢して課題を遂行する必要があります(抑制コントロール)。 2重遺伝子導入後、私たちは、サルがこの1DR課題を行っている途中で、CNOを静脈路から投与しました。同時に、サルのLPFCとCdNからは多チャンネルを同時計測可能な針型電極を用いて局所電場電位を計測しました。また、コントロールとして、CNOを抜いた溶剤(vehcle: VEH)を投与する条件でも実験を行いました。そして、サルの行動や神経活動における変化を、CNO投与前後およびCNO/VEH条件間で比較することで解析しました。
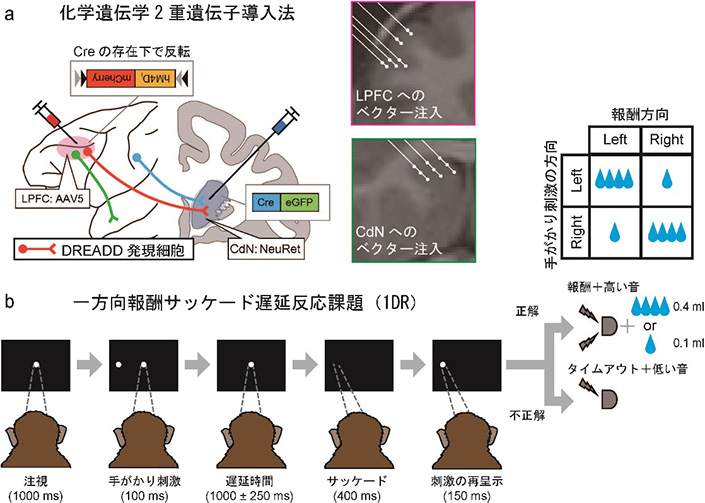 図1 経路選択的な人工受容体発現と行動課題
図1 経路選択的な人工受容体発現と行動課題実験結果
記録実験において、サルはまず160試行の1DRタスクを行いました。その後、CNOないしはVEHを静脈路から投与されました。続けて、サルは720試行を行い、最後まで終えればセッションは完了となります。CNOはこの720試行の間に徐々に脳へと移行していくと考えられます。実験の結果、コントロールとなるVEH条件では、サルは多くのセッションで最後まで課題を完遂することができました。これに対して、CNO条件では、徐々に連続でエラーするようになっていき、最後まで課題を完遂できなくなるセッションの割合が増加しました(図2a)。投与後のエラーの連続回数もVEH条件に比べてCNO条件の方が平均して長くなりました(図2b)。これらの結果は、CNOによってLPFC-CdN経路の活動を制御することで、サルが課題を最後まで遂行するための忍耐力が低下したということを示唆しています。続いて、サルが報酬を得るために行う眼球運動の解析を行いました。結果、CNO条件では、VEH条件に比べて、サッケード(急速眼球運動)のピーク速度が速くなり(図2c)、潜時が短くなる(図2d)という変化が確認できました。この結果は、サルの眼球運動における衝動性が亢進したということを示唆しています。いずれの行動変化も2重遺伝子導入を行う前では観察されませんでした。
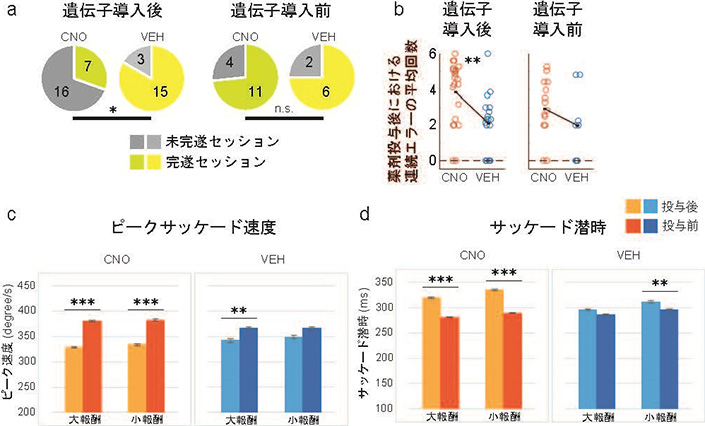 図2 CNO条件における行動変化
図2 CNO条件における行動変化LPFCとCdNから記録した局所電場電位に関して時間周波数解析を行ったところ、手がかり刺激の呈示後に特徴的な正の応答信号が見られました。この応答信号は特に大報酬の時に強く見られました。CNOの投与後、この刺激応答が減弱化することが確認されました(図3a)。また、サッケードを行うタイミングでは特徴的な負の成分が見られましたが、この成分もCNO投与後にはゼロに近づいて減弱化することが確認されました(図3b)。LPFC-CdN経路を構成する神経細胞が制御されたことで、課題関連のこうした信号にも変化が生じたと考えられます。
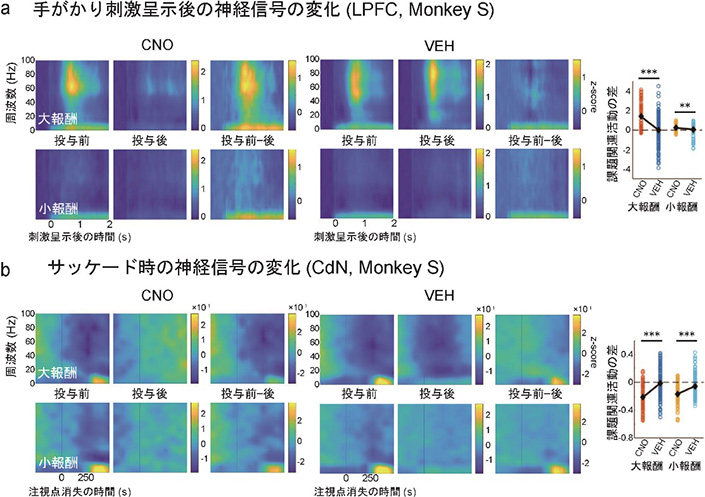 図3 CNO条件における神経活動の変化
図3 CNO条件における神経活動の変化最後に、記録実験の終了後に免疫抗体染色を行ったところ、サルのLPFCとCdNからは、2重遺伝子導入が成功したことを示すレポータータンパク質の発現が確認できました(図4)。このことは、LPFCとCdNの両部位での遺伝子導入が成功裡に行われたことを示しています。
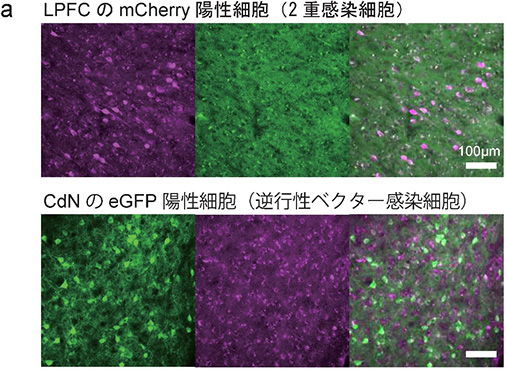 図4 2重遺伝子導入によるLPFCとCdNでの蛍光タンパク質の発現
図4 2重遺伝子導入によるLPFCとCdNでの蛍光タンパク質の発現将来的な展望
以上のように、私たちは、化学遺伝学2重遺伝子導入法によってLPFC-CdN経路を構成する神経細胞を選択的に制御し、その結果、抑制コントロール機能の低下を示す行動変化や、課題に関連する神経活動の減弱化を捉えることに成功しました。
この成果は、霊長類を用いたより精密な神経回路研究への歩みを前進させるものであり、私たちの研究グループでも、前頭前野ネットワークを構成する経路間の機能分離など、さらなる展開を進めています。また、当該経路との関係が指摘されているさまざまな精神疾患(統合失調症や注意欠陥多動性障害、強迫性障害、薬物依存症など)の病態解明や、DREADDを用いた神経回路の薬理的操作による新たな治療法の開発へも結びつくことが期待されます。
研究グループ
- 玉川大学脳科学研究所
特任准教授 小口 峰樹(おぐち みねき)
- 新潟大学医学部
助教 田中 慎吾(たなか しんご)
- 華東理工大学認知神経動態研究所
教授 潘 晓川(Xiaochuan Pan)
- 麻布大学獣医学部
教授 菊水 健史(きくすい たけふみ)
- 東京都医学総合研究所
研究員 守屋 敬子(もりや けいこ)
- 福島県立医科大学生体機能研究部門
准教授 加藤 成樹(かとう しげき)
- 福島県立医科大学生体機能研究部門
教授 小林 和人(こばやし かずと)
- 玉川大学脳科学研究所
教授 坂上 雅道(さかがみ まさみち)