【脳科学研究所 研究成果】脳領域間の相互通信を一挙に観測する手法を開発! 脳の通信プロトコル解読に向けてさらなる前進
玉川大学脳科学研究所の酒井裕教授、箕谷啓太研究員、東京医科歯科大学の礒村宜和教授、川端政則 助教の共同研究グループは、「脳の通信プロトコル(手順)」を解読する研究を大きく前進させる、コリジョンテスト(※用語解説)の自動化・並列化を実現しました。これにより、脳の異なる領域間で相互にやりとりしている神経スパイク信号を一挙に観測することが可能になりました。このコリジョンテストという技術はスパイク衝突(コリジョン)という現象を利用しており、従来のコリジョンテストでは、神経細胞ごとに1対1に調べていく必要があるため、効率性に問題がありました。今回の研究では、多チャンネル電極で多数の神経細胞のスパイク信号を同時に記録、瞬時に処理して、処理した結果に基づき複数の箇所の脳内刺激を制御するリアルタイム実験システムを開発し、コリジョンテストの自動化・並列化を実現しました。これにより、複数の脳領域間の相互通信を観測すること可能にしました。本研究の成果は、脳神経科学の重要な基盤技術の一つとして、脳の異なる領域は互いにスパイク信号を使ってどのように通信しているのか、すなわち「脳の通信プロトコル(手順)」を解読する研究を大きく前進させることが期待されます。本研究成果は、9月3日(土)に科学雑誌 “iScience” (Cell Press)でオンライン掲載されました。
掲載論文名
Automated and parallelized spike collision tests to identify spike signal projections
スパイク信号投射を同定するスパイクコリジョンテストの自動化と並列化
この研究のポイント
- 脳の異なる領域間で相互にやりとりする神経スパイク信号を一挙に観測する手法を開発
- 多数のスパイク信号をリアルタイムに高速処理しながら脳内刺激を制御するシステムを構築
- 神経スパイク信号の記録と投射先の神経繊維の刺激が可能な限り、脳のどの領域間でも同定可能
研究の背景
私たちの脳は異なる機能を持つ多数の領域にわかれており、領域間で神経スパイク信号(パルス状の電気信号)をやりとりすることで複雑な脳機能が実現されています。この信号のやりとりは、膨大な数の神経細胞が遠く離れた脳領域まで伸ばした神経線維(軸索)を介して行われます。近くに位置する神経細胞でも、その投射パターンは神経細胞ごとに全く異なっており、計測しているスパイク信号が、どの領域に伝達されているのかを同定するのは一般に困難でした。しかし近年、遺伝子技術が発達し、特定の投射だけに遺伝子発現できるようになったため、特定の投射に伝わる神経活動を観測できるようになりました。ただし、遺伝子技術による同定では、特定の遺伝子や遺伝子導入の仕方に依存するため、同時に同定できる投射パターンに制限があります。
一方、古くから行われていたスパイク衝突を用いた同定法(コリジョンテスト※用語解説)は、投射元のスパイク信号の記録と投射先の軸索刺激が可能であれば、原理的には脳内のどこでも、どんな投射パターンでも同時に同定することが可能です。しかし、従来のコリジョンテストでは、細胞単位の関係を遠く離れた部位でピンポイントに当てなければならないため、特定の投射関係が密な限られた系でしか、実施されてきませんでした。
これに対し、以前、私たちの研究グループは、多チャンネル電極で多数の神経細胞を記録しながら、光遺伝学の技術を用いて投射先を広範囲に刺激し、効率よくコリジョンテストを行うMulti-Linc(multi-areal and multi-neuronal light-induced collision)法という手法を開発しました。これにより、従来のコリジョンテストより同定効率が飛躍的に向上し、様々な脳領域間に適用することが可能となりました。ただし、このMulti-Linc法では、実験者がスパイク信号を多数の電極をそれぞれ目で見て確認し、実験装置を手動で操作しながら一つ一つの細胞についてコリジョンテストをしていたため、膨大な実験時間と手間がかかっていました。したがって、同時に同定できる投射パターンに限界がありました。
そこで本研究では、Multi-Linc法を自動化し並列化することによって、多数の投射パターンを並列で調べることを可能にし、同時に同定するパターン数を向上させることを目指しました。
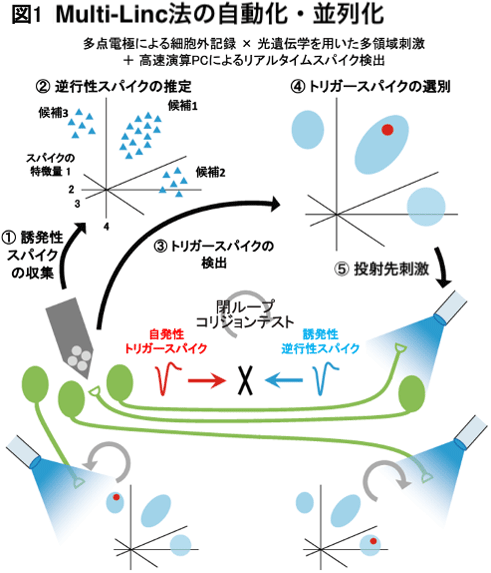
この研究の鍵となる一つ目のポイントは、多チャンネル電極信号の高速転送とリアルタイムスパイク検出アルゴリズムを用いることで、自発性スパイクを検出してから数ミリ秒以内に投射先の軸索刺激を行うシステムを開発したところです(図1)。今回、研究グループが考案した自動実験システムは、まず、投射先刺激に誘発されるスパイクを収集し(図1①)逆行性だと思われるスパイクの特徴をあらかじめ計算します(図1 ②、アルゴリズムの詳細は図2)。次に、これらの逆行性スパイク候補と類似した特徴を持つ自発性スパイクが検出された直後に投射先刺激を行うことでスパイクコリジョンテストを行います。ここで重要なことは、電極付近の細胞体から記録した自発性スパイクが軸索末端にたどり着く前に刺激を行わないとコリジョンが起きないということです。このスパイク信号は数ミリ秒から10数ミリ秒程度までの非常に短い時間で伝導してしまうので、非常に素早く自発性スパイクの特徴を分析し選別する必要があります。そこで、私たちは多チャンネル電極の信号をリアルタイムにコンピューターに転送し、高速計算することによって、自発性スパイクを検出してからすぐにトリガースパイクの選別をすることを可能としました(図1③④)。多細胞記録電極から多数検出されるトリガースパイクのうち、逆行性スパイク候補のどれかと類似していた場合にPCがすばやく投射先刺激をトリガーします(図1⑤)。このように自動的に行われる検出と刺激のループを実験対象となる脳領域のすべてに対して並列に適用することで、高い効率での神経細胞の投射先の同定を実現しました。
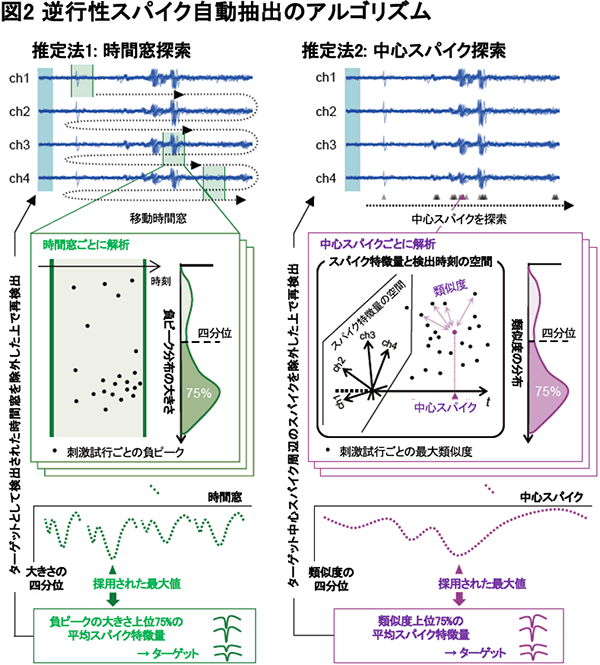
この研究の二つ目のポイントは、逆行性でないシナプス性スパイクなどを多数含んだ誘発性スパイクの中から逆行性スパイクの候補を自動で抽出するアルゴリズムを初めて開発したところです(図2)。これまでの実験では実験者がオシロスコープを目で見て逆行性スパイクの候補を確認していたため、ほかのスパイクや脳波と重なっていると見逃してしまうことがありました。そこで、多数のスパイクの中から逆行性スパイクの特徴をうまく評価し、逆行性スパイクの候補を抽出するアルゴリズムを二種類考案しました。この逆行性スパイクの特徴には時間的安定性と波形的安定性の二つがあります。時間的安定性とは、刺激を行なってからスパイクが検出されるまでの時間が安定していることで、シナプス伝達を介さない逆行性スパイクにおいては安定性が高くなっています。次に波形的安定性は、刺激に誘発されたスパイク波形が安定していることで、これは同じ神経細胞由来のスパイクでは同じようなパターンの信号となり安定性が高くなります。推定法1では時間窓をスライドさせて、刺激に対して最も安定して大きなスパイクが発生している時間帯を探索します。推定法2では、検出されたすべてのスパイクの中から、類似した波形のスパイクが近いタイミングで最も多く発生しているスパイク(中心スパイク)を探索します。これらの方法で探索された時間窓で発生するスパイクや、中心スパイクと類似するスパイクを逆行性スパイク候補群として抽出します。このようなアルゴリズムによって多数のスパイク信号の中から逆行性スパイクを自動で抽出することに成功しました。
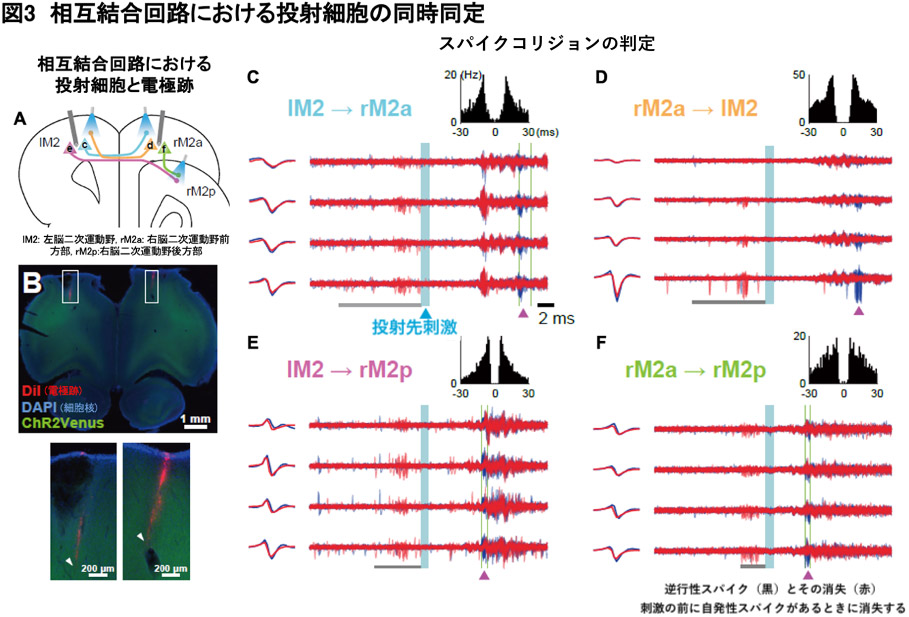
自動並列Multi-Linc法の有効性を示すため、本手法をラット大脳皮質の異なる領域(左右の運動野)に適用したところ、どちらの推定法でも効率よく投射先を同定でき、1回の実験あたり最大で12個の神経細胞の投射を明らかにすることができました。さらに、左脳と右脳の二次運動野間を相互に結合している神経細胞群を同時に同定することもできました(図3)。この相互結合は脳機能の連携に重要だと考えられますが、これまでの手法ではこの相互結合を同時に同定することは困難でした。このように、本手法は脳領域間の情報伝達を高効率に同定可能であることを実証しました。
将来的な展望
本研究では、行動中の動物における脳領域間の情報伝達を細胞単位かつミリ秒単位で効率よく追跡する革新的な脳活動計測技術を、自動化・並列化することによって大幅に効率を改善しました。本研究の成果は、脳神経科学の重要な基盤技術の一つとして、異なる脳領域間で神経細胞同士が一体どのように情報をやりとりしているのか、すなわち「脳の通信プロトコル(手順)」を解明する研究を進展させることが期待されます。
※用語解説
コリジョンテストとは
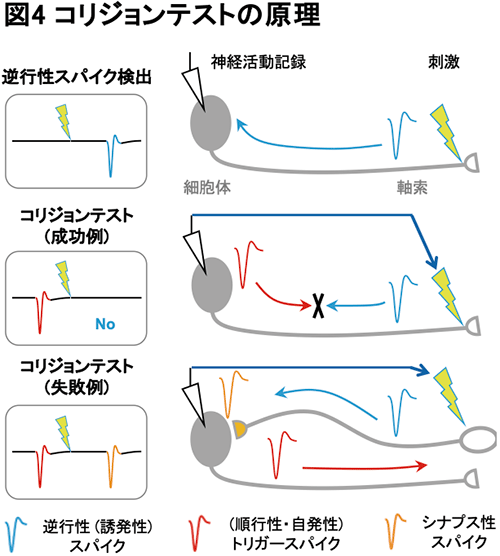
コリジョンテストではまず、対象となる脳領域を人為的に刺激することで軸索から細胞体に向かって通常とは逆方向に伝達するスパイク(逆行性スパイク)を記録領域に置かれた電極から観測します(図4上段)。次に、記録している領域で自発的なスパイク(トリガースパイク)が出たのを検出した直後に刺激を行い、逆行性スパイクを発生させます。このとき、トリガースパイクが逆行性スパイクと同時に同じ軸索を伝導していればスパイクが衝突して、細胞体で観測されるはずの逆行性スパイクが観測されなくなります(図4中段)。一方で、同じ軸索を伝導せず神経細胞間の信号伝達を担うシナプスを介してスパイクが発生していた場合などは刺激によって誘発されたスパイクが観測されたままとなります(図4下段)。このスパイク信号の消失が十分観測された場合をコリジョン成功とし、成功判定された細胞は刺激を行なった領域に軸索を伸ばしていることを意味します。
本研究について
玉川大学、東京医科歯科大学の共同研究として、日本医療研究開発機構(AMED)の脳とこころの研究推進プログラム「革新的技術による脳機能ネットワークの全容解明プロジェクト」、科学技術振興機構(JST)戦略的創造研究推進事業(CREST) 光の特性を活用した生命機能の時空間制御技術の開発と応用(オプトバイオ)、文部科学省科学研究費補助金の新学術領域「適応回路シフト」「時間生成学」「脳情報動態」、日本学術振興会科学研究費補助金、武田科学振興財団などの支援により実施されました。
研究グループ
玉川大学脳科学研究所 嘱託研究員 箕谷 啓太(みたに けいた)
東京医科歯科大学 助教 川端 政則(かわばた まさのり)
東京医科歯科大学 教授 礒村 宜和(いそむら よしかず)
玉川大学脳科学研究所 教授 酒井 裕(さかい ゆたか)